私たちの研究室では、「味覚」を中心とした口腔感覚情報の生理調節機能を分子から個体に至る各レベルで解析し、「味覚障害」や「生活習慣病」の新たな予防・治療法の開発を目指しています。
私たちは、体調によって味覚が変化することを日常的に経験します。例えば、風邪を引くと味がしない。今日はなぜかチョコレートが食べたいな。汗をかいた後はポカリスエットが本当に美味しい。お腹が空いた時にはどんな食べ物でも御馳走だ!このように、味覚は体内の栄養状態により変化することで必要な栄養素(甘味=カロリー、塩味=ミネラル、うま味=タンパク質、酸味=有機酸や不廃物、苦味=毒)の摂取を調節していると考えられます。では、もし味覚が無くなってしまうとどうなるでしょうか? 食べ物が美味しくないので食べられません(必要な栄養素が取れません)。悲しい気持ちになり食欲も下がって、もっと食べられなくなり栄養失調に、深刻な場合にはフレイル(加齢による心身の活力低下状態)に陥る可能性が考えられます。他にも、偏った栄養素の過剰摂取により、生活習慣病(肥満、糖尿病、高血圧、高脂血症)を発症してしまう可能性も考えられます。味覚を健常に保つことは、健康に生きる上でとても重要なのです。
私たちの研究室では、「味覚を健常に保つ方法」、「おかしくなった味覚を戻してあげる方法」を開発することが、心身の健康維持に貢献できるとても有効な手段であると考えて、日々、研究に取り組んでいます。
| (1)口腔感覚(特に味覚)の受容・伝達・修飾・認知に関わる分子神経機構の解明:味覚受容の分子メカニズムは未だ多くの謎が残っています。例えば、甘、塩、酸、苦、うま味は5基本味と考えられていますが、これらの中で酸味や塩味(電解質)の受容体は未だ不明であり、またそれぞれの味情報を味細胞から味神経へ伝える神経伝達物質もほとんど分かっていません。そこで、私たちは、様々な遺伝子改変マウス(右:肥満・糖尿病マウス(db/db:甘味物質に感受性が高い)と正常マウス、その他にも、甘味/うま味受容体T1r3-欠損(KO)または発現細胞が緑に光る(GFP)マウス, 甘味うま味苦味関連Trpm5-KO, gustducin-GFP, 酸味関連GAD-GFPなど)を用いることで未知の分子を探り出し、様々な手法を駆使してその分子機能を解明していきたいと考えています。
|

|

|
(2)摂食・嚥下障害(特に味覚障害)の発症に関わる分子機序の解明とその治療基盤の開発: 味覚障害は苦味は分かるが甘味が分からないなどの症状として現れ、QOL低下の直接的な原因になりえます。突発性、亜鉛欠乏性、全身疾患など様々な原因でおこりますが、その治療方法は確立しておらず主に亜鉛投与などの対処療法が行なわれています。これは発症の分子基盤が加齢変性、神経症状、ホルモン異常、脳機能障害など多様であり、またこれらの複合として現れる可能性もあり、一元的な解析が困難なためです。この問題を解決するために、薬剤の副作用による味覚異常を切り口としてその分子基盤の解明に取り組み、さらに臨床講座との積極的な連携を通じて治療法の開発を目指したいと考えています。
|
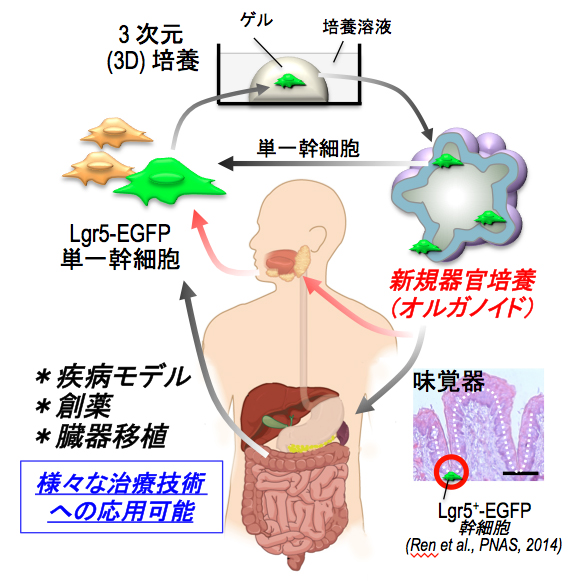
(3)味蕾オルガノイド(試験管ミニ臓器)を用いた再生医療法の開発:動物個体を用いたin vivo実験から得られるデータは多くの生体機能を反映しているため非常に重要です。しかし、この動物実験には動物の命、時間とコストを伴うため、新たな実験系の開発が求められていました。オルガノイド法は、単一の幹細胞から3次元的に組織を誘導し、何ヶ月も繰り返し培養することが可能な方法であり、様々な分子(分化、増殖、成長、栄養、細胞死、受容体、情報伝達など)の影響をハイスループット、リアルタイムそして客観的に解析出来る特徴をもっています。最近、我々はこのオルガノイド法をもちいて味蕾の再生に成功しました。今後、この方法を新規に探し出した様々な分子機能の解明に利用し、さらに味覚異常の原因解明、それに対する創薬、そして再生医療にも応用していきたいと考えています。
|
|
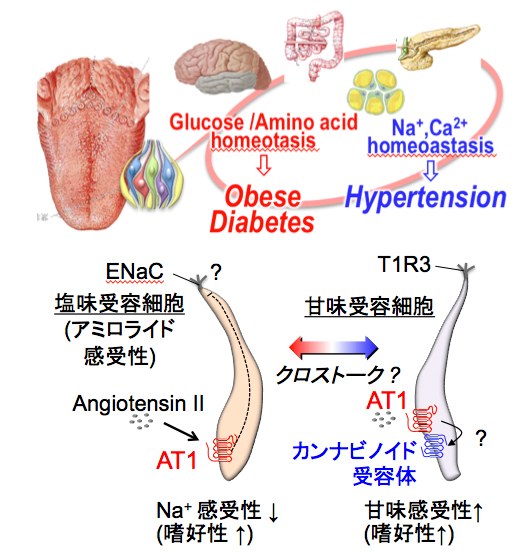 |
(4)全身性疾患(特に生活習慣病と感染症)の発症に関わる味覚関連分子の機能解明と応用技術の開発:食欲抑制ホルモンのレプチンと食欲促進物質の内因性カンナビノイドは、視床下部に拮抗的に作用して摂食量を調節します。この拮抗的調節メカニズムが甘味受容細胞に存在することが分かり、さらに消化管内分泌細胞にも存在することが明らかになってきました。このことから、味覚器-脳-消化管が甘味システムを介して巧妙に連携する新たな体内エネルギー調節メカニズムの存在が見えはじめてきました。さらに最近我々は、血圧調節ホルモンであるアンジオテンシンIIが塩味を抑制するだけでなく、甘味も増強することを発見しました。肥満者の高血圧の発症率は非肥満者に比べて2〜3倍高いことが知られていますが、この背景にアンジオテンシンIIの味覚調節による塩分および糖分両方の摂取量が増えてしまうことがその原因のひとつである可能性を推定しています。このような全身における味覚受容システムの機能について各基本味レベルで追求しています。 |
(5)Big Data (2000検査項目x2000人)をもちいたヒト味覚感受性の多様性の原因解析と全身性疾患との相関解析:我々の味覚感受性は個人差が大きく、人種差があることも報告されています。よく知られているものに苦味物質フェニルチオカルバミド(PTC)に対して感受性が低い「味盲」がありますが、この原因が苦味受容体T2R38のアミノ酸変異をともなう3つの遺伝子変異にあることが明らかにされました。その後、我々はうま味感受性の個人差の原因がT1R1+T1R3の遺伝子変異にある可能性を示唆し、さらに甘味や他の苦味についても味覚受容体の遺伝子変異にある可能性が報告されています。しかし、他の味質や受容体以外の情報伝達分子の関連についてはほとんど不明です。そこで、これらの個人差の原因、さらに全身における味覚システムの関与を明らかにすることを目的として、ヒトにおける味覚認知閾値、ホルモン濃度、味覚受容体の1塩基多型性(single nucleotide polymorphism: SNP)との相関解析を行い、さらに生活習慣病(肥満、糖尿病、高血圧など)との相関についても解析を進めています。 | 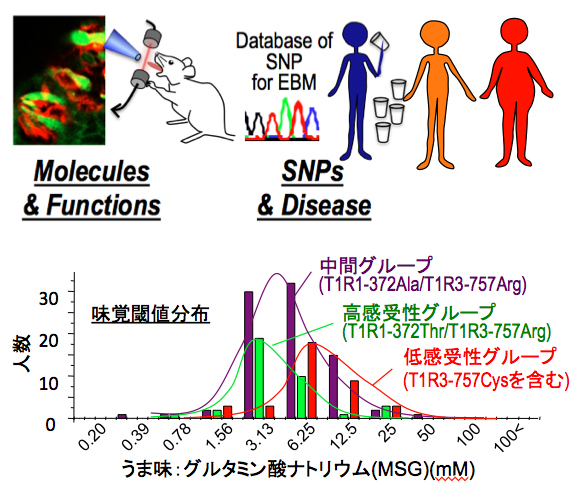 |
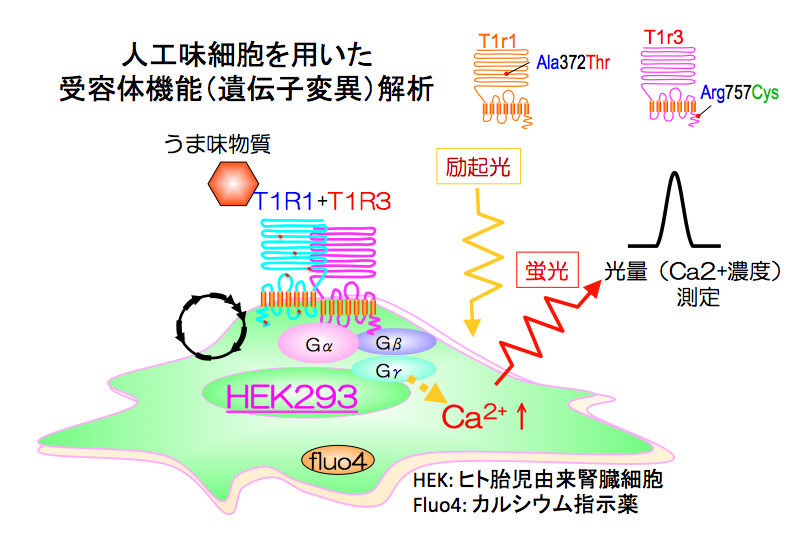 | (6)人工味細胞と分子動力学(molecular dynamics simulation)を用いた味覚受容体の機能解析:ヒトの味覚感受性の個人差の原因が味覚受容体の遺伝子変異である可能性が予想された場合、客観的にその遺伝子変異による影響を調べる必要があります。そこで、HEK293培養細胞に味覚受容体 (正常体と変異体) を強制発現させた人工味受容細胞を構築して、それらの味物質の結合サイトの同定や活性化メカニズムなどの機能解析を行なっています。さらにスーパーコンピューターを使って味覚受容体の構造変化(1マイクロ秒間)をシミュレーションします。これまでに、ヒトうま味感受性の個人差の原因がうま味受容体T1R1+T1R3の遺伝子変異にある可能性を示唆しました。また、甘味を抑制するギムネマ酸や酸っぱいものが甘くなるミラクリンの謎についても、この系をもちいて解き明かすことが出来ました。さらに今後は、ヒトのインスリン分泌細胞やナトリウム吸収細胞などの人工味覚受容細胞を構築して味覚受容体の様々な臓器における異なる機能について解析を進めていきたいと考えています。
|

